Fibromyalgie les causes
- Jérôme HERISSE

- 8 janv. 2020
- 49 min de lecture
Dernière mise à jour : 11 nov. 2021
Hérissé Jérôme naturopathe et magnétiseur passionné par téléconsultation en ligne.
Fibromyalgie, SFC, SCI et autres douleurs chroniques résulteraient d'une dérégulation du système nerveux central
Plusieurs syndromes de douleur chronique tels que la fibromyalgie, le syndrome de fatigue chronique (SFC) et le syndrome du côlon irritable (SCI) ne peuvent être expliqués par une cause organique persistante telle qu'une lésion ou une inflammation de tissus comme les muscles ou les articulations, ou de nerfs.
Dans certains de ces syndromes, lorsqu'une lésion et/ou une inflammation contribuent, ou ont contribué à la douleur, elles semblent ne pas pouvoir l'expliquer complètement.
Un phénomène de « sensibilisation centrale » a été proposé pour expliquer ces syndromes. Il s'agit d'une dérégulation du système nerveux central (cerveau et moelle épinière) qui provoque une hyperexcitabilité neuronale entraînant une amplification de la douleur et une hypersensibilité sensorielle.
La sensibilisation centrale est caractérisée par une allodynie (douleur provoquée par des stimuli ne causant normalement pas de douleur tels que le frôlement de vêtements) ; une hyperalgésie (douleur amplifiée en réponse à des stimuli normalement douloureux) ; une extension du champ réceptif (douleur s'étendant au-delà de la zone normale) ; et une douleur anormalement prolongée après le retrait d'un stimulus douloureux.
La présence d'une sensibilisation centrale a été démontrée dans différents syndromes de douleur chronique par des comparaisons des seuils de douleur à divers stimuli (électrique, pression, froid et chaleur) et par l'imagerie cérébrale lors de tests de douleur notamment.
Le terme « syndrome de sensibilité centrale » a été proposé par MB Yunus en 2000 pour regrouper ces syndromes dans lesquels la sensibilisation centrale joue un rôle. (TEST de dépistage des syndromes de sensibilité cérébrale)
Outre la fibromyalgie, le syndrome de fatigue chronique et le syndrome du côlon irritable, d'autres syndromes douloureux, souvent considérés comme des syndromes de douleur nociceptive (lésion ou inflammation de tissus) ou neuropathique (lésion de nerfs), peuvent aussi impliquer certains degrés de sensibilisation centrale : par exemple, le syndrome de la douleur myofasciale, le trouble de l'articulation temporo-mandibulaire, le syndrome du côlon irritable, la migraine et la céphalée de tension, le syndrome des jambes sans repos et la sensibilité chimique multiple, mentionnent Tom G. Mayer, Randy Neblett et leurs collègues (Pain Practice, 2012).
Les mécanismes centraux sont aussi susceptibles d'expliquer d'autres symptômes qui accompagnent souvent la douleur chronique tels que la fatigue.
L'Inventaire de sensibilisation centrale évalue 25 symptômes souvent associés aux syndromes de sensibilité centrale et recense les diagnostics médicaux déjà reçus au moyen d'une liste de 10 syndromes de sensibilité centrale et de conditions reliées. (Faites le test)
D'autres mécanismes que la sensibilisation ont également été associés aux « syndromes de sensibilité centrale ». Par exemple, un dysfonctionnement du système du stress, dont l'axe hypothalamo-hypophyso-surrénalien.
Daniel J. Clauw et ses collègues (Clinical Journal of Pain, 2016) ont situé quelques syndromes de douleur chronique sur un continuum allant de la douleur chronique nociceptive à la douleur d'origine centrale en passant par la douleur neuropathique :
Kathleen A. Sluka et Daniel J. Clauw (Neuroscience, 2016) ont récemment décrit les données de recherche qui appuient un rôle important de mécanismes de sensibilisation centrale dans la fibromyalgie et des troubles apparentés. Cette sensibilisation expliquerait notamment les bénéfices de l'exercice, connu pour altérer la transmission de certains neurotransmetteurs. Des études récentes (2011-2013) ont toutefois commencé à explorer, rapportent-ils, des altérations du système nerveux périphérique qui contribueraient potentiellement à la douleur de la fibromyalgie. (Dans certains cas, la fibromyalgie serait plutôt une neuropathie parfois traitable, L'hypothèse d'une neuropathie des petites fibres se précise.)
Des chercheurs font valoir que le terme « syndrome de sensibilité centrale » devrait remplacer d'autres termes, qui ne devraient plus être utilisés, tels que « syndrome somatique fonctionnel », « syndrome médicalement inexpliqué », « trouble somatoforme », « douleur psychogène » et « somatisation » parce qu'il est plus précis et exact (Yunus, Seminars in arthritis and rheumatism, 2008).
En plus d'une hyperexcitabilité de certains neurones du système nerveux central et d'une altération de la modulation descendante de la douleur (voyez l'illustration plus bas), l'inflammation chronique joue probablement un rôle dans la pathophysiologie de la fibromyalgie, selon une étude publiée dans le Journal of Pain Research.
📷
Selon des études précédentes portant sur l'analyse de cytokines (protéines jouant un rôle de messager dans le système immunitaire) et d'autres protéines liées à l'inflammation, des mécanismes neuroinflammatoires sont considérés comme étant centraux dans la pathophysiologie de nombreuses conditions de douleur chronique.
Mais en ce qui concerne la fibromyalgie, les études précédentes n'ont porté que sur quelques cytokines. Emmanuel Bäckryd de l'Université Linköping (Suède) et ses collègues (1) ont réalisé une analyse portant sur 92 protéines liées à l'inflammation afin d'établir un profil beaucoup plus complet.
Ils ont comparé la présence de ces protéines dans le liquide céphalo-rachidien et le plasma sanguin (LCR) de 40 personnes atteintes de fibromyalgie, 10 personnes en santé et 46 donneurs de sang.
Ils ont trouvé des signes de neuroinflammation (dans le LCR) et d'inflammation chronique systémique (dans le plasma sanguin) distinctifs chez les personnes atteintes de fibromyalgie.
Deux groupes de protéines permettaient fortement de discriminer les personnes fibromyalgiques. En particulier, des niveaux élevés de la chimiokine CX3CL1 (ou fractalkine) dans le LCR et d'interleukine 8 (IL-8) dans le sang et dans le LCR ont été constatés. Des études précédentes avaient aussi montré des niveaux élevés d'IL-8 dans la fibromyalgie.
Plusieurs chimiokines dont les niveaux étaient plus élevés déclenchent l'activation de cytokines qui entraînent une neuroinflammation. Ces résultats sont ainsi en concordance avec les études qui suggèrent un rôle de la neuroimmunité dans la douleur chronique, concluent les chercheurs.
Ces résultats doivent être confirmés par des études avec d'autres cohortes, mentionnent-ils.
Mais si l'on tient pour acquis qu'ils sont valides, la question suivante se pose, soulignent-ils. Est-ce que la signature inflammatoire identifiée est directement liée à la physiopathologie de la fibromyalgie (par exemple, causant la sensibilisation centrale qui est connue pour être impliquée dans la fibromyalgie) ou est-elle un facteur de risque inflammatoire qui était présent avant le développement de la douleur chronique ? Une troisième possibilité pourrait être que l'inflammation est une conséquence de la fibromyalgie (par exemple, due au stress lié à la douleur, à l'inactivité, à la dépression ou au mauvais sommeil).
« Que la signature inflammatoire soit un facteur de risque, un miroir direct ou une conséquence des processus pathophysiologiques impliqués dans la fibromyalgie représente donc un domaine important pour de nouvelles recherches. Bien sûr, les trois de ces catégories peuvent jouer un rôle. »
Plusieurs études au cours des dernières années indiquent que les symptômes de la fibromyalgie peuvent provenir d'un dysfonctionnement mitochondrial. Mais qu'est-ce que cela signifie réellement? Dans ce post, je vais expliquer ce qu'est la dysfonction mitochondriale et comment elle conduit non seulement à la douleur et à la fatigue, mais aussi à de nombreux autres symptômes de la fibromyalgie.
Alors que les scientifiques en apprennent davantage sur le rôle des mitochondries dans la santé et les maladies, ils ont conclu que le dysfonctionnement mitochondrial est à l'origine de nombreuses maladies et affections. La liste des maladies et affections connues avec une composante de dysfonction mitochondriale est longue et s'allonge. Il est même responsable du processus de vieillissement lui-même.
Les mitochondries sont le moteur de presque tous les êtres vivants avec des structures cellulaires complexes, y compris les animaux, les plantes et les êtres humains. Ils fournissent de l'énergie aux cellules pour qu'elles se déplacent, se divisent et tout ce dont elles ont besoin pour fonctionner correctement.
La fonction principale des mitochondries est d'absorber les nutriments, de les décomposer et de créer de l'énergie pour les cellules. Chaque cellule de notre corps contient des mitochondries. Certaines cellules ont besoin de beaucoup d'énergie comme les cellules du cerveau et des muscles, elles contiennent donc des milliers de mitochondries. Les cellules qui ne nécessitent pas beaucoup d'énergie contiennent moins de mitochondries.
Comment le corps produit de l'énergie
Le cerveau, le cœur, les muscles, les cellules nerveuses, etc. ont tous des tâches différentes à accomplir. Pour faire ces travaux, il faut de l'énergie. L'énergie est fournie aux cellules par les mitochondries. Les mitochondries absorbent les nutriments et créent une énergie chimique sous forme d'ATP (Adénosine Tri-Phosphate). La molécule ATP contient de l'énergie stockée. Une fois l'énergie épuisée, elle se transforme en ADP (adénosine di-phosphate).
L'ADP repasse ensuite dans les mitochondries, où il est recyclé en ATP. Le processus nécessite de l'oxygène et est extrêmement efficace. Chez une personne en bonne santé, l'ATP est recyclé toutes les 10 secondes environ. Si le processus ralentit, les cellules ralentissent, toutes les fonctions corporelles ralentissent et des problèmes surviennent.
Lorsque notre corps a besoin de plus d'énergie plus rapidement qu'il ne peut en fournir, il existe un autre moyen pour le corps de fournir cette énergie. Lorsque l'organisme manque d'ATP, il peut en faire une petite quantité directement à partir du glucose ( D-ribose ) en le convertissant en acide lactique.
Cependant, cela entraîne deux problèmes graves. Tout d'abord, l'acide lactique s'accumule rapidement, en particulier dans les muscles, provoquant des douleurs, des lourdeurs, des douleurs et des douleurs. Deuxièmement, aucun glucose n'est disponible pour fabriquer le D-ribose , donc aucun nouvel ATP ne peut être fabriqué. La demande d'énergie dépasse la livraison d'énergie, entraînant de la fatigue.
Dysfonctionnement mitochondrial et fibromyalgie
De nombreuses études suggèrent que la dysfonction mitochondriale pourrait jouer un rôle important dans la fibromyalgie. Les biopsies musculaires ont trouvé des schémas de dysfonctionnement mitochondrial (mitochondries anormales, défauts mitochondriaux et anomalies des fibres musculaires) similaires à ceux que l'on trouve généralement dans les troubles mitochondriaux.
Presque tous les symptômes de la fibromyalgie peuvent être expliqués par un dysfonctionnement mitochondrial. Douleur, fatigue, maux de tête et migraine , IBS, intolérance à la chaleur et au froid, transpiration, marbrures de la peau, problèmes de fréquence cardiaque et de pression artérielle, étourdissements et problèmes d'équilibre, vision floue, troubles du sommeil, etc.
La dysfonction mitochondriale peut affecter n'importe quel organe ou système organique du corps. Selon le Dr Mark Hyman , les mitochondries ne sont pas bien protégées et facilement endommagées par les toxines, les infections, les allergènes et les souches . Mais l'une des plus grandes insultes au fil du temps est le régime alimentaire américain standard.
Les médicaments sont ne autre cause majeure de dommages mitochondriaux. Toutes les classes de médicaments psychotropes (qui incluent les antidépresseurs et les médicaments anti-anxiété) ont été documentées pour endommager les mitochondries, ainsi que les statines, les analgésiques tels que l'acétaminophène et bien d'autres. Voici le lien vers la liste des médicaments signalés présentant une toxicité mitochondriale .
Fatigue chronique et fibromyalgie : une production de mauvaise énergie au cœur des deux syndromes ?
Des recherches sur le syndrome de fatigue chronique (SFC) et la fibromyalgie se sont tournées vers les niveaux anormalement élevés, dans ces deux syndromes, de lactate (ou acide lactique) dans le sang, les muscles et le cerveau. De quoi ces niveaux peuvent-ils être révélateurs ?
Le lactate, un sous-produit du métabolisme anaérobique de l'énergie (production de l'énergie qui ne requière pas d'oxygène), est ordinairement pompé hors des cellules en grande quantité pendant l'effort physique.
Les niveaux élevés dans le SFC et la fibromyalgie, suggèrent que les besoins en énergie sont en grande partie comblés par la production d'énergie anaérobique (appelée glycolyse), qui est un système de production d'énergie « sale », peu productif avec des sous-produits toxiques, n'intervenant que lorsque le système de production d'énergie aérobie est épuisé, explique le blogueur Cort Johnson (en anglais).
Le lactate est normalement associé, chez les personnes en santé, à la douleur musculaire, à la fatigue et à d'autres symptômes après un exercice excessif.
Au cours des 10 dernières années, Benjamin H. Natelson du Mount Sinai Beth Israel (New York) et Dikoma C. Shungu du Weill Cornell Medicine ont documenté des augmentation importante du lactate dans le liquide céphalo-rachidien des personnes atteintes du SFC ainsi que de fortes diminutions des taux de glutathion, un important antioxydant du cerveau. Ces deux constatations sont mises en relation dans leurs hypothèses sur les processus de la maladie.
Dans une étude récente, publiée dans la revue Fatigue : Biomedicine, Health and Behavior (FBHB), ils ont, avec leurs collègues (1), constaté que les niveaux de lactate dans la fibromyalgie étaient également élevés, ce qui n'était pas le cas chez les personnes en santé.
Les auteurs croient que ces niveaux élevés sont susceptibles d'être un élément central des deux syndromes.
Les niveaux élevés de lactate sont essentiellement synonymes de dysfonction mitochondriale, a expliqué le Dr Shogun, spécialiste des maladies mitochondriales, au blogueur. (Les mitochondries produisent l'énergie dans les cellules.)
Dans le cas du SFC et de la fibromyalgie, il croit que les dysfonctions des mitochondries ne sont pas le moteur de la maladie, mais apparaissent secondairement à d'autres problèmes.
Ses travaux des dernières années l'ont amené à considérer que le stress oxydatif (causé par les radicaux libres contre lesquels agissent les antioxydants) et ses conséquences pathophysiologiques seraient la cause la plus probable des niveaux élevés de lactate.
Dans ses recherches récentes, financées par les National Institutes of Health (NIH) américains, il a confirmé que les niveaux de stress oxydatif étaient en lien avec les symptômes du SFC. La découverte de niveaux cérébraux de glutathion très réduits dans le SFC suggère que les systèmes antioxydants qui gardent normalement le stress oxydatif sous contrôle ne le font plus.
Un indice important dans l'élaboration du modèle explicatif du SFC de Shungu a été des niveaux élevés d'isoprostanes constatés dans deux études du SFC.
Voici son modèle actuel de la maladie :
Un déclencheur immunologique ou un agent pathogène active la production de cytokines (messagers du système immunitaire) pro-inflammatoires et un puissant radical libre, le peroxynitrite.
Les réserves antioxydants inadéquates (comme indiqué par les faibles niveaux de glutathion) entraînent une réaction du peroxynitrite avec les lipides pour former des isoprostanes.
Les isoprostanes - vasoconstricteurs puissants - compriment les vaisseaux sanguins, réduisent le flux sanguin et produisent un environnement hypoxique (à faible teneur en oxygène).
Cet environnement à faible teneur en oxygène a pour conséquence :
l'augmentation de la production d'énergie sans oxygène (glycolyse) ;
la transformation du pyruvate en lactate.
Le stress oxydatif, la neuroinflammation et le dysfonctionnement mitochondrial sont des « co-conspirateurs » dans la production du SFC, de la fibromyalgie et d'autres maladies (comme le syndrome du côlon irritable notamment), estime Shungu.
Dans la fibromyalgie, il favorise l'hypothèse selon laquelle les niveaux de lactate dans le liquide céphalo-rachidien seraient causés par des mécanismes différents de ceux du SFC et que la neuroinflammation serait le principal moteur.
Ce modèle suggère, estime le chercheur, que pour le traitement de la fibromyalgie, une combinaison de médicaments qui ciblerait les différents facteurs pourrait être plus efficace qu'un seul médicament. Combiner le complément alimentaire N-acétylcystéine (NAC) pour élever les taux de glutathion dans le cerveau et atténuer le stress oxydatif, avec, par exemple, un anti-inflammatoire non stéroïdien (AINS) pour cibler l'inflammation pourrait être plus efficace que l'une ou l'autre intervention seule.
Un essai clinique du NAC qu'il a mené, dont la publication est à venir, aurait obtenu des résultats positifs, rapporte le blogueur.
Quant aux niveaux de lactate, un médicament testé pour les maladies mitochondriales (le dichloroacétate) s'est avéré trop toxique, indique le chercheur.
SFC : un trouble de la production d'énergie dans les cellules
Fibromyalgie : un profil de neuroinflammation et d'inflammation systémique distinctif
Pour plus d'informations sur le syndrome de fatigue chronique et la fibromyalgie, voyez aussi les liens plus bas.
(1) Diana Vu, Jeremy D. Coplan, Xiangling Mao, Michelle Blate, Guoxin Kang, Eli Soto, Tolga Kapusuz.
Le lien entre la fibromyalgie et le microbiot intestinal établie pour la première fois
Les scientifiques ont découvert une corrélation entre une maladie impliquant une douleur chronique et des altérations du microbiome intestinal.
Dans un article publié aujourd'hui dans le journal Pain , une équipe de chercheurs basée à Montréal a montré, pour la première fois, qu'il y avait des altérations de la bactérie dans le tractus gastro-intestinal des personnes atteintes de fibromyalgie. Environ 20 espèces différentes de bactéries ont été trouvées en quantités plus grandes ou plus petites dans les microbiomes des participants atteints de la maladie que dans le groupe témoin sain.
Présence ou absence accrue de certaines espèces de bactéries
«Nous avons eu recours à diverses techniques, y compris l’intelligence artificielle, pour confirmer que les changements observés dans les microbiomes des patients fibromyalgiques n’étaient pas causés par des facteurs tels que le régime alimentaire, les médicaments, l’activité physique, l’âge, etc. le microbiome », déclare le Dr Amir Minerbi, de l’unité de gestion de la douleur Alan Edwards du Centre universitaire de santé McGill (CUSM), et premier auteur de ce document. L'équipe comprenait également des chercheurs de l'Université McGill et de l'Université de Montréal, ainsi que d'autres chercheurs de l'Institut de recherche du CUSM.
Le Dr Minerbi a ajouté: «Nous avons constaté que la fibromyalgie et ses symptômes - douleur, fatigue et difficultés cognitives - contribuaient plus que tout autre facteur aux variations observées dans les microbiomes des personnes atteintes. Nous avons également constaté que la gravité des symptômes d'un patient était directement corrélée à une présence accrue ou à une absence plus prononcée de certaines bactéries, ce qui n'a jamais été signalé auparavant.
📷
«Nous avons trié de grandes quantités de données et identifié 19 espèces qui ont augmenté ou diminué chez les personnes atteintes de fibromyalgie», explique Emmanuel Gonzalez, du Centre canadien de génomique computationnelle et du Département de génétique humaine de l'Université McGill. «En utilisant l’apprentissage automatique, notre ordinateur a pu établir un diagnostic de fibromyalgie fondé uniquement sur la composition du microbiome, avec une précision de 87%. Tandis que nous développons cette première découverte en menant davantage de recherches, nous espérons améliorer cette précision, en créant potentiellement un changement radical dans le diagnostic. "
«Les personnes atteintes de fibromyalgie souffrent non seulement des symptômes de leur maladie, mais également de la difficulté de la famille, des amis et des équipes médicales à comprendre leurs symptômes», a déclaré Yoram Shir, auteur principal du journal, directeur du journal Alan Edwards Pain. Unité de gestion du CUSM et chercheur associé du programme BRaiN de l’IR-CUSM. «En tant que médecins spécialisés dans la douleur, nous sommes frustrés par notre incapacité à aider et cette frustration est un bon carburant pour la recherche. C’est la première preuve, du moins chez l’homme, que le microbiome pourrait avoir un effet sur la douleur diffuse, et nous avons vraiment besoin de nouvelles méthodes de traitement de la douleur chronique. »
Ces espèces supposément appauvries (dont l'abondance relative est plus faible) dans la FM étaient relativement bien caractérisées et incluaient F. prausnitzii , B. uniformis , P. copri et Blautia faecis . F. prausnitzii est l'une des bactéries productrices de butyrate les plus abondantes et les mieux étudiées dans l'intestin humain. 45 Cette espèce a été signalée comme épuisée dans de multiples maladies intestinales et a donc été suggérée comme marqueur potentiel de troubles intestinaux. Dans l'intestin, F. prausnitziiaurait exercé des effets antinociceptifs et anti-inflammatoires 57,78 et amélioré la fonction de barrière intestinale. 45 Semblable à nos observations, F. prausnitzii a également été signalé comme épuisé chez les patients atteints de SFC. 60
B. uniformis est l'une des nombreuses espèces qui ont récemment été signalées comme ayant altéré l'abondance relative chez les patients atteints d'arthrite inflammatoire, ainsi que Haemophilus parainfluenzae , P. copri et d'autres. 95 B. uniformis et H. parainfluenzae ont été détectés dans les tissus synoviaux des articulations arthrosiques, tandis que P. copri et H. parainfluenzae ont été détectés dans le liquide synovial de la polyarthrite rhumatoïde. On pense que P. copri agit comme médiateur de la réponse inflammatoire par l'activation de Th17, 36,42 et il a également été démontré qu'il induisait l'arthrite dans un modèle animal de souris sujettes à l'arthrite. 50Dans cette étude, ces espèces ont été trouvées en plus faible abondance chez les patients FM. Bien que la FM soit souvent considérée comme une maladie rhumatologique, il semble qu'au moins certaines espèces précédemment trouvées en plus grande abondance dans les maladies rhumatismales inflammatoires soient épuisées dans la FM.
Contrairement à l'épuisement des producteurs de butyrate F. prausnitzii et B. uniformis chez les patients atteints de FM, nous avons observé une abondance relative significativement plus élevée d'un certain nombre d'autres producteurs connus de butyrate intestinal: I. butyriciproducens , F. plautii , B. desmolans , E. tayi et E. massiliensis récemment identifié . 1,3,10,12,37,81,87 Les altérations des espèces métabolisant le butyrate et le propionate ont été soutenues par des altérations des taux sériques de ces acides gras à chaîne courte. Cohérent avec ce changement présumé dans la communauté productrice de butyrate des patients atteints de FM, Parabacteroides merdaeétait également significativement plus élevée en abondance relative chez les patients atteints de FM. Récemment, P. merdae a été signalé par Olson et al. être l'un des 2 médiateurs clés de l'effet antiépileptique du régime cétogène 63 : dans un modèle de souris, le régime cétogène peut entraîner une augmentation de l'abondance de P. merdae , qui à son tour, par la régulation de la γ-glutamylation des acides aminés, conduit à une augmentation du rapport acide hippocampique γ-aminobutyrique (GABA) / glutamate. On pense que l'augmentation du rapport inhibiteur / neurotransmetteur excitateur dans le cerveau protège contre les crises. La deuxième espèce de médiateur clé de l'effet du régime cétogène sur les crises rapportée par Olson et al. était Akkermansia muciniphila, qui dans notre cohorte a également été trouvée à une plus grande abondance chez les patients atteints de FM, bien que cette observation n'ait pas atteint une signification statistique ( P = 0,042, Benjamini – Hochberg FDR = 0,27).
Clostridium scindens et B. desmolans , 2 espèces bactériennes capables de convertir le cortisol en androgènes par l'activité 20α-hydroxystéroïde déshydrogénase, 8,18,59,72,80 ont été trouvées en plus grande abondance chez les patients FM. Fait intéressant, une régulation anormale de l'axe hypothalamo-hypophyso-surrénalien a été rapportée chez des patients atteints de FM, bien que la direction de la dérégulation soit controversée. 20,79
La fibromyalgie partage des caractéristiques cliniques avec plusieurs syndromes, dont IBS, CFS et IC. Des altérations spécifiques du microbiote intestinal ont été signalées dans tous ces syndromes (IBS, 69,70,82,97 CFS, 60 et IC 9 ). Bien que plusieurs taxons, trouvés ici comme étant des DA dans la FM, aient également été signalés comme étant des DA dans d'autres syndromes qui se chevauchent, d'autres taxons semblent être uniques à la FM. Par exemple, C. scindens a été trouvé à une plus grande abondance à la fois dans la FM et dans le CFS. H. parainfluenzae et F. prausnitzii ont été trouvés à une diminution de l'abondance dans la FM et dans le SFC, et ce dernier a également été signalé comme épuisé chez les patients IC. 9 Plusieurs genres, dont Bacteroides, Parabacteroideset Clostridium ont été trouvés DA à la fois dans IBS et dans FM (indépendant de IBS). 70,82,97 Néanmoins, quelques taxons ont montré un modèle d'abondance différentielle inverse: par exemple, P. merdae, significativement plus élevé dans la FM, aurait été épuisé dans le SCF. 60 En outre, la FM est associée à une fréquence élevée de comorbidité en santé mentale, principalement de l'anxiété et de la dépression affectant 40% à 80% des individus. 2,31 L' anxiété, la dépression et le stress émotionnel ont été associés à des altérations du microbiome intestinal dans la population générale 40et dans le contexte d'autres diagnostics spécifiques. Des recherches récentes de Peter et al. (2018) a révélé l'importance potentielle de la santé mentale en tant que facteur dans le SCI, suggérant que des recherches interdisciplinaires supplémentaires sont nécessaires pour bien comprendre les différences de microbiome identifiées ici. 69 Il semble donc que la FM partage certaines caractéristiques du microbiome avec plusieurs syndromes qui se chevauchent, tout en conservant certaines caractéristiques uniques.
Dans cette étude, un effort a été fait pour valider le diagnostic de chaque patient par une évaluation médicale approfondie par des spécialistes de la douleur expérimentés, excluant ainsi plus de 15% des patients interrogés. Nous considérons la caractérisation minutieuse des phénotypes des patients, une force importante de cette étude. Une évaluation complète de l'apport alimentaire a été réalisée pour près de 80% des participants et analysée par une équipe de nutritionnistes. À notre connaissance, ce type d'évaluation approfondie n'est pas systématiquement effectué dans des études similaires. Enfin, chaque participant a subi un examen médical complet, y compris la documentation de leurs comorbidités (avec une évaluation spécifique pour IBS), la consommation de médicaments, l'activité physique et le sommeil. Ces mesures ont abouti à une cohorte cas-témoins bien équilibrée, presque identique en démographie, anthropométrie, comorbidités, apport médicamenteux non douloureux et apport alimentaire. De plus, l’étendue des données collectées nous a permis d’évaluer l’effet de chaque variable sur la variance observéecomposition du microbiome et pour détecter les facteurs de confusion potentiels. La cohorte de 156 participants a fourni une puissance statistique solide. Nous avons utilisé 2 méthodes de séquençage - amplification du gène de l'ARNr 16S et analyses métagénomiques WGS - chacune avec ses propres avantages et inconvénients, pour permettre une validation indépendante de la composition du microbiome . La combinaison d'une grande taille de cohorte avec une grande couverture a permis d'identifier des espèces d'AD à faible prévalence, telles que I. butyriciproducens . La métabolomique sérique ciblée a permis un soutien indépendant de certaines des altérations observées dans le microbiome intestinal. Les résultats de cette étude doivent être considérés à la lumière de plusieurs limites: premièrement, les symptômes de la FM comprennent la douleur chronique, la fatigue et d'autres symptômes somatiques, excluant l'attribution d'une altération spécifique du microbiome à une présentation clinique spécifique. Deuxièmement, plus de 90% des participants se sont déclarés de race blanche, ce qui ne reflète peut-être pas les profils de microbiome dans d'autres groupes ethniques. Troisièmement, les diagnostics des participants ont été enregistrés sur la base d'un entretien clinique systématique, ce qui pourrait potentiellement conduire à un sous-diagnostic. Les conditions de santé mentale peuvent être sous-représentées chez les patients atteints de FM (tableau supplémentaire 5, disponible sur http://links.lww.com/PAIN/A839) par rapport aux symptômes autodéclarés (tableau supplémentaire 2, les participants n'ont pas été évalués par un spécialiste des soins de santé mentale, disponible sur http://links.lww.com/PAIN/A839 ). Enfin, cette étude a été conçue pour trouver une association entre la composition du microbiome et la FM, ne permettant pas de tirer des conclusions directes concernant la causalité ou les mécanismes d'action.
Les résultats présentés ici sont, à notre connaissance, les premiers à démontrer une altération du microbiote du tractus gastro-intestinal chez les patients souffrant de douleur somatique (non viscérale) en général, et de FM en particulier. Certains des taxons DA rapportés ici sont connus pour être impliqués dans des voies métaboliques dont l'effet sur les symptômes de la FM est biologiquement plausible. De plus, il semble y avoir une corrélation quantitative entre l'abondance de plusieurs taxons et la gravité des symptômes. Enfin, les taxons DA chez les patients atteints de FM partagent certaines similitudes avec les syndromes dysfonctionnels qui se chevauchent - IBS, CFS, IC - tout en conservant certains taxons DA uniques.
Les résultats de cette étude fournissent des preuves d'altérations des altérations du microbiome intestinal dans la FM. D'autres études sont nécessaires pour mesurer les changements possibles du microbiome dans d'autres conditions de douleur chronique et pour explorer les corrélations causales potentielles entre le microbiome intestinal et la FM. Nos résultats peuvent offrir des opportunités importantes pour améliorer notre compréhension de la FM, aider à son diagnostic et peut-être définir les modalités thérapeutiques futures. Premièrement, l'exploration des mécanismes par lesquels le microbiote intestinal peut affecter la nociception pourrait offrir de nouvelles perspectives sur la pathogenèse et la physiopathologie de la FM, et peut-être suggérer des pistes pour explorer les effets possibles des événements déclencheurs, de la sensibilité personnelle et du pronostic individuel. Deuxièmement, la précision du microbiomeLa classification basée sur l'apprentissage automatique suggère que le microbiome a le potentiel d'aider au diagnostic de la FM à l'avenir. Enfin, si une relation causale entre les altérations du microbiome intestinal et la FM est établie, la voie peut être ouverte pour le développement de nouvelles modalités de traitement ciblant cette communauté fascinante de micro-organismes intestinaux.
Bugs de douleur: microbiote intestinal et troubles de la douleur
Liens d'auteur ouvrir le panneau de superpositionKieran Rea 1Siobhain O'Mahony 1 3Timothy G Dinan 1 2John F Cryan 1 3
L'axe microbiote-intestin – cerveau est une «autoroute de la communication» multidirectionnelle complexe et dynamique dans le corps, y compris le système nerveux central, le système nerveux autonome, les systèmes neuroendocrinien et neuro-immunitaire, le système lymphatique, le système nerveux entérique et le système gastro-intestinal. le microbiote. Les mécanismes de communication se décomposent lentement et impliquent les principaux systèmes mentionnés ainsi que les sous-produits produits tels que les neuropeptides, les neurotransmetteurs, les hormones et les modulateurs immunitaires. Au cours de la dernière décennie, des preuves croissantes indiquent un rôle essentiel de cet axe dans de nombreux processus neuronaux fondamentaux et troubles cérébraux. Cependant, les études cliniques et précliniques limitées ne définissent pas clairement le rôle du microbiote intestinal dans la physiopathologie de l'état douloureux. Le domaine le plus étudié concerne le syndrome du côlon irritable et les études sur la douleur viscérale dans des modèles animaux. Cependant, on ne peut ignorer l'implication du microbiote dans les symptômes qui sont comorbides avec la douleur chronique, en particulier les troubles affectifs. Dans cette revue, nous synthétisons les informations disponibles mettant en évidence le microbiote intestinal dans les états de douleur viscérale, inflammatoire et neuropathique, y compris la fibromyalgie, la migraine, le cancer et la douleur associée à la chimiothérapie. Étant donné son rôle dans de nombreux systèmes effecteurs, il est clairement nécessaire de mener des enquêtes plus ciblées sur le mécanisme d'action du microbiote dans les états de douleur humaine, car les stratégies de traitement actuelles sont souvent inefficaces ou offrent un soulagement limité. on ne peut ignorer l'implication du microbiote dans les symptômes qui sont comorbides avec la douleur chronique, en particulier les troubles affectifs. Dans cette revue, nous synthétisons les informations disponibles mettant en évidence le microbiote intestinal dans les états de douleur viscérale, inflammatoire et neuropathique, y compris la fibromyalgie, la migraine, le cancer et la douleur associée à la chimiothérapie. Étant donné son rôle dans de nombreux systèmes effecteurs, il est clairement nécessaire de mener des enquêtes plus ciblées sur le mécanisme d'action du microbiote dans les états de douleur humaine, car les stratégies de traitement actuelles sont souvent inefficaces ou offrent un soulagement limité. on ne peut ignorer l'implication du microbiote dans les symptômes qui sont comorbides avec la douleur chronique, en particulier les troubles affectifs. Dans cette revue, nous synthétisons les informations disponibles mettant en évidence le microbiote intestinal dans les états de douleur viscérale, inflammatoire et neuropathique, y compris la fibromyalgie, la migraine, le cancer et la douleur associée à la chimiothérapie. Étant donné son rôle dans de nombreux systèmes effecteurs, il est clairement nécessaire de mener des enquêtes plus ciblées sur le mécanisme d'action du microbiote dans les états de douleur humaine, car les stratégies de traitement actuelles sont souvent inefficaces ou offrent un soulagement limité.
Le microbiote intestinal: mécanismes d'action
L'importance de la communication bidirectionnelle entre l'intestin et le cerveau dans la santé et la maladie est reconnue depuis longtemps. Cependant, au cours des deux dernières décennies, le microbiote (les milliards de micro-organismes, y compris les bactéries, les bactériophages, les archées, les protozoaires et les champignons qui vivent dans et sur notre corps) est devenu l'un des principaux régulateurs de la fonction intestinale-cérébrale tout au long de la vie. Il a été déterminé que de nombreux facteurs peuvent influencer l'établissement du microbiote de base qui informe le développement de l'hôte tout au long de la vie, notamment l'infection, le mode d'accouchement, l'utilisation d'antibiotiques, la nature de l'apport nutritionnel, les facteurs de stress environnementaux et la génétique de l'hôte [ 1 •]. Cela a conduit à son tour à l'appréciation de la communication entre le microbiote et l'intestin – cerveau dans une myriade de troubles, y compris les troubles psychiatriques, métaboliques, neurodéveloppementaux, liés à l'âge et neurodégénératifs [ 1 • ].
Des études, en grande partie sur des modèles animaux, ont montré que le microbiote régule les processus neuronaux fondamentaux, de la neurogenèse et de la myélinisation, à l'activation de la microglie et des processus neuroinflammatoires [ 2], et qui sont tous impliqués dans les processus douloureux. Malgré cela, le rôle du microbiote dans le déclenchement, le développement, le maintien et la progression des troubles de la douleur a été étonnamment peu étudié. Le microbiote et le cerveau communiquent entre eux par diverses voies, y compris le système immunitaire et inflammatoire, les mécanismes endocriniens, le métabolisme du tryptophane, la communication neuronale entérique et vague, ainsi que par le biais de métabolites microbiens tels que les acides gras à chaîne courte, les acides aminés à chaîne ramifiée, les peptidoglycanes ainsi que de nombreux autres peptides et biomolécules messagères secondaires. En effet, plusieurs de ces métabolites ont été identifiés dans le traitement de la douleur.
Types de douleur
La douleur est une expérience multimodale combinant une composante sensorielle discriminante avec une réponse émotionnelle graduée complexe. Cette installation de survie physiologique est généralement transitoire ou rapide (douleur aiguë) et est inhérente à tous les organismes sensibles pour se protéger contre les dommages tissulaires potentiels ou existants. Les douleurs aiguës et chroniques peuvent être débilitantes et peuvent influencer l'état d'esprit et contribuer aux symptômes comorbides, notamment le stress, l'anxiété et la dépression, qui à leur tour peuvent amplifier l'intensité psychologique de la douleur [ 3]. Dans cette revue, nous nous concentrons davantage sur les douleurs chroniques. En gros, les types de douleur peuvent être classés comme douleur nociceptive, douleur inflammatoire ou douleur pathologique. La douleur nociceptive est notre réponse classique à un stimulus douloureux comme une piqûre d'épingle, où les récepteurs de la douleur à nos extrémités détectent le stimulus et transmettent le signal au cerveau. Les amines et peptides vasoactifs, les eicosanoïdes, les cytokines pro-inflammatoires et les protéines en phase aiguë dans le processus inflammatoire empêchent d'autres lésions tissulaires et entraînent finalement la guérison et la restauration de la fonction tissulaire, mais une inflammation prolongée due à une infection ou à des lésions tissulaires peut être néfaste et douloureuse pour le hôte. La douleur pathologique peut être un état pathologique causé par des dommages au système nerveux ou par sa fonction anormale (par exemple, la douleur neuropathique, la fibromyalgie, la migraine et les maux de tête) [4 ].
Dans ces catégories, la douleur peut être davantage sous-caractérisée comme somatique (musculo-squelettique, cutanée et profonde) ou viscérale (liée aux organes internes). Les voies anatomiques et les mécanismes de signalisation impliqués dans la douleur somatique / musculo-squelettique et les réponses aux agressions nociceptives aiguës et à la douleur inflammatoire aiguë sont relativement bien définis. Cependant, les mécanismes qui sous-tendent la douleur viscérale, la douleur neuropathique et la douleur chronique, et leur traitement s'avèrent une cible difficile pour une intervention thérapeutique.
Voies de la douleur
La perception de la douleur et de l'inconfort implique des mécanismes complexes, y compris les mécanismes de transduction moléculaire et cellulaire et la plasticité neuronale qui conduisent à l'activation périphérique des nerfs sensoriels et, au niveau central, à la régulation des voies de signalisation thalamiques et corticolimbiques (voir figure 1 ). De manière aiguë, après un événement comme une blessure, un stress ou une infection, les informations nociceptives codant pour la chaleur (inflammation) ou la douleur se propagent du site d'origine aux afférences vagales ou par des voies vertébrales ascendantes vers le cerveau. Les nocicepteurs des viscères et de la peau et des tissus réagissent à une stimulation mécanique telle qu'une distension ou une pression, des lésions tissulaires et une stimulation chimique en raison d'une inflammation, d'une infection ou d'une ischémie.
📷
Graphique 1 .Schéma décrivant le rôle potentiel du microbiote intestinal dans la douleur nociceptive, inflammatoire et neuropathique. Le microbiote peut communiquer des informations nociceptives au cerveau par diverses voies, y compris les systèmes immunitaire et inflammatoire, les mécanismes endocriniens, la communication neuronale entérique et vague, ainsi que par le biais de métabolites microbiens tels que les acides gras à chaîne courte, les acides aminés à chaîne ramifiée, le neurotransmetteur, les peptidoglycanes et d'autres peptides et biomolécules messagères secondaires. Les signaux nociceptifs se propagent via les nerfs afférents rachidiens à travers la moelle épinière jusqu'au cerveau, tandis que les signaux nociceptifs inflammatoires ou neuropathiques peuvent être communiqués via des signaux vagaux ou via des biomolécules dans le système lymphatique ou circulatoire qui peuvent traverser la barrière hémato-encéphalique pour médier le traitement central de la douleur. .
ANS: Système nerveux autonome; DC: cellule dendritique; NT: neurotransmetteur; NP: Neuropeptide; SCFA: acides gras à chaîne courte.
Cependant, après une activation prolongée ou chronique, les neurones impliqués dans la transmission d'informations nociceptives peuvent également devenir sensibilisés ou dysfonctionnels conduisant à la conductance d'un signal douloureux vers ce qui devrait être un stimulus inoffensif (douleur neuropathique). Un dysfonctionnement des voies de la douleur dans les loci anatomiques au site de la blessure ou une communication neuronale du site de la blessure le long de la moelle épinière vers le cerveau et les régions suprarachidiennes impliquées dans la facilitation et l'inhibition de la douleur descendante peut conduire à des épisodes chroniques, répétés et souvent imprévisibles de la douleur et peut être la racine d'où provient la douleur neuropathique. Ainsi, en ciblant des produits chimiques bioactifs clés ou des systèmes récepteurs sur ces neurones afférents sensoriels, ou ceux des sites supraspinaux, la sensation de tous les types de douleur (nociceptive,
Mécanismes potentiels induits par le microbiote dans la régulation de la douleur
Localement, l'intestin contient un certain nombre de types de récepteurs différents impliqués dans le traitement de la réponse à la douleur, y compris les canaux potentiels des récepteurs transitoires, de la famille des sous-types de vanilloïdes (TRPV), des récepteurs activés par la protéinase, des récepteurs de la cholécystokinine, des récepteurs de la sérotonine, des récepteurs des cannabinoïdes, ainsi que un réseau de canaux ioniques comprenant des canaux ioniques à déclenchement ATP, des canaux sodium et calcium à tension dépendante et des canaux ioniques à détection d'acide [ 5 ]. Le microbiote gastro-intestinal peut activer ces récepteurs directement ou indirectement par le biais de réponses immunitaires [ 6] à la surface des muqueuses pendant l'infection, l'inflammation et l'auto-immunité, ou via la libération de peptides de formyle et de protéases, les changements de pH, la libération d'acides gras polyinsaturés (PUFA), la production d'acides gras à chaîne courte (SCFA), la production de neurotransmetteurs et la sécrétion d'hormones [ 7 ]. Il a également été démontré que les bactéries induisent un flux de calcium et des potentiels d'action dans les neurones nocicepteurs [ 8 • ].
En plus d'influencer les réponses immunitaires locales au niveau de l'épithélium intestinal, le microbiote peut synthétiser et libérer des neurotransmetteurs et des AGCC, réguler le métabolisme des stéroïdes et des acides biliaires, ainsi qu'influencer la libération de neuropeptides et d'hormones des cellules entéroendocrines des intestins. Certains d'entre eux pourraient potentiellement jouer un rôle dans les types de douleur tels que la migraine en contribuant à la vasoconstriction. Une étude approfondie récente [ 9] a également mis en évidence un rôle crucial du microbiote gastro-intestinal dans la maturation, la morphologie et la fonction immunologique de la microglie centrale - un événement qui peut extrapoler à la microglie rachidienne, mais cela n'a pas encore été testé. Compte tenu du rôle intégrateur de la microglie dans de nombreux processus centraux, dont la neuroinflammation, il est plausible que cette contribution du microbiote puisse influencer le traitement central de la douleur. Le microbiote gastro-intestinal peut également stimuler la libération des biomolécules naturelles anti-douleur du corps, y compris les opioïdes des neutrophiles et des monocytes innés, les endocannabinoïdes du tissu colique, ainsi que d'autres modulateurs de la douleur [ 10 •] y compris les monoamines. Les métabolites microbiens peuvent également influencer les mécanismes épigénétiques, en modifiant les concentrations du substrat ou en inhibant directement la machinerie enzymatique dans les voies épigénétiques [ 11 ]. Potentiellement, ces cytokines, chimiokines, messagers endocriniens et sous-produits microbiens circulants peuvent s'infiltrer dans le sang et les systèmes lymphatiques, ou influencer les messages neuronaux véhiculés par les neurones afférents vagaux et rachidiens pour avoir un impact sur les événements médiés centralement et spinalement, afin de moduler différemment la réponse à types de douleurs nociceptives, inflammatoires et neuropathiques.
Ci-dessous, nous synthétisons les preuves du microbiote dans la réponse à la douleur, mais le profil temporel de l'influence médiée par le microbiote sur la réponse de la douleur à la douleur aiguë et chronique reste, pour l'instant, une question critique et non traitée.
Preuve d'un rôle du microbiote gastro-intestinal dans la réponse à la douleur
Les études cliniques et précliniques étudiant le rôle du microbiote dans les douleurs nociceptives (viscérales et somatiques), inflammatoires et neuropathiques sont limitées. Une grande partie des preuves cliniques du microbiote gastro-intestinal dans la réponse à la douleur s'est concentrée sur les troubles nociceptifs de l'intestin, tandis que les études précliniques incorporent des réponses à la douleur nociceptive, neuropathique et inflammatoire dans tout le corps.
Douleur viscérale
Les souris exemptes de germes (élevées dans un environnement stérile clos exempt de germes et exempt de tout micro-organisme) ont montré une sensibilité accrue à la douleur dans le modèle de distension colorectale [ 12 ], un modèle animal de douleur viscérale. Une autre preuve d'un rôle actif du microbiote intestinal dans la réponse à la douleur est l'utilisation d'antibiotiques pour épuiser la charge bactérienne. Chez les animaux naïfs, la déplétion médiée par les antibiotiques du microbiote gastro-intestinal a diminué la réponse liée à la douleur viscérale chez la souris [ 13 ] et le rat [ 14 ], et l'exposition précoce aux antibiotiques prédisposait les animaux à une sensibilité viscérale à l'âge adulte [ 15]. Récemment, la transplantation de matières fécales contenant les microbes intestinaux (greffe de matières fécales ou FMT) de patients atteints du syndrome du côlon irritable (IBS) présentant une hypersensibilité à la distension colorectale a été transplantée chez des rats exempts de germes, et la réponse à la distension colorectale a été améliorée chez ces animaux [ 16 • ], suggérant à nouveau un rôle pour les microbes intestinaux dans la manifestation et la physiopathologie de la maladie.
Chez l'homme, la supplémentation en FMT et en probiotiques a été étudiée dans les troubles de la douleur viscérale, y compris les troubles gastro-intestinaux fonctionnels (FGID) tels que la dyspepsie fonctionnelle, le SCI et les coliques infantiles - et des preuves cliniques et précliniques d'un rôle du microbiote intestinal dans la douleur viscérale sont synthétisées dans un revue récente [ 17 ]. Actuellement, les données sur la FMT sur la douleur dans les FGID sont trop limitées pour tirer des conclusions [ 18 ]. En termes de sensibilité viscérale à la douleur chez les personnes souffrant du SII, très peu d'études randomisées en double aveugle contrôlées par placebo ont rapporté un effet bénéfique des probiotiques ou des mélanges de probiotiques sur les symptômes, y compris la douleur / l'inconfort, la distension / les ballonnements, l'urgence et la dysfonction digestive. Un rôle pour les probiotiques en pédiatrie [ 19] les troubles gastro-intestinaux fonctionnels sont bien passés en revue dans un article récent rapportant des effets modestes ou faibles sur l'intensité ou la fréquence de la douleur. Les études cliniques manipulant le microbiote pour soulager les symptômes de la douleur viscérale et / ou inflammatoire associée à l'infarctus du myocarde (crise cardiaque), la dysménorrhée, l'appendicite, les douleurs de la vessie font défaut, avec une seule étude rapportant une réduction de la douleur pelvienne avec la symptomatologie comorbide IBS après un antibiotique ( rifaximine) [ 20 ].
dysfonction endocrinienne et fibromyalgie :
Des perturbations du système endocrinien ont été aperçues dans les cas de fibromyalgie
Mélatonine :
Dans un groupe de 9 femmes atteintes de FM, la concentration plasmatique de mélatonine, principal synchronisateur du système circadien, est modérément augmentée la nuit par rapport aux témoins.
Résumé des articles du dr Kurland sur l’hypothyroïdie (http://www.fibrokur.com/P767/) :
L’hypothyroïdie est un état pathologique dû à un déficit en hormones thyroïdiennes. La thyroïde secrète deux hormones, la T4 et la T3. Seule la T3 est active. Elles sont régulées par la TSH, hormone secrétée par l’hypophyse, glande située à la base de cerveau. L’hypothyroïdie est dite primaire lorsqu’elle est due à un trouble de la thyroïde elle-même, dans la majorité des cas d’origine auto-immune (thyroïdite d’Hashimoto).
Elle est dite secondaire ou centrale, dans 5 à 10% des cas, lorsqu’elle est due à un trouble de l’hypophyse. Un taux de la TSH élevé au-delà de la norme traduit habituellement une hypothyroïdie, mais ce n’est pas toujours la règle.
Il faut savoir, et ce n’est pas connu de tous les médecins, qu’une TSH dans les valeurs de référence ”normales” n’exclut pas une hypothyroïdie. La TSH souvent ne reflète pas un état d’hypo-métabolisme thyroïdien pourtant déjà cliniquement manifeste. Plus encore et paradoxalement, le taux de la TSH est bas ou normal dans l’hypothyroïdie secondaire ou centrale, rendant dans ce cas le diagnostic d’hypothyroïdie difficile et souvent ignoré.
Pourquoi l’étude de l’hypothyroïdie a sa place dans un site qui traite de la fibromyalgie? – Premièrement, parce que ces deux affections ont des symptômes très semblables. – Deuxièmement, parce que l’hypothyroïdie est une des causes principales de la fibromyalgie. – Troisièmement, parce que dans le tableau clinique de l’hypothyroïdie peuvent également exister des douleurs musculo-squelettiques et que nombre de patientes étiquetées souffrant de la fibromyalgie ne souffrent en vérité que d’une hypothyroïdie non diagnostiquée. – Quatrièmement, parce que les deux affections, fibromyalgie et hypothyroïdie d’Hashimoto, peuvent coexister, étant toutes les deux de nature auto-immune (trouble du système immunitaire). – Cinquièmement, parce que s’il est vrai qu’un traumatisme physique ou psychique peut être le ”trigger” (évènement gâchette) au développement des symptômes de la fibromyalgie, il s’avère que nombre de ces patients présentaient déjà un état hypo-métabolique d’hypothyroïdie avant que le traumatisme ne survienne. – Sixièmement, si dans la population générale l’hypothyroïdie secondaire ou centrale ne se retrouve que dans 5 à 10% ces cas d’hypothyroïdie, l’hypothyroïdie responsable de la fibromyalgie est dans plus de 50% des cas une hypothyroïdie secondaire ou centrale, de diagnostic, comme nous l’avons dit plus haut, habituellement méconnu ou ignoré en raison d’une TSH basse ou normale. – Septièmement, sur le plan thérapeutique, parce qu’une large majorité des patients souffrant de fibromyalgie et du syndrome de la fatigue chronique et présentant des symptômes d’hypothyroïdie avec des tests sanguins normaux sont significativement améliorés par des traitements hormonaux qui visent à restaurer le métabolisme thyroïdien. – Huitièmement, une fatigue des glandes surrénales est souvent associée à l’hypothyroïdie et également présente très fréquemment chez les patients souffrants de fibromyalgie et du syndrome de la fatigue chronique.
La méconnaissance d’une fatigue des glandes surrénales est parfois responsable de l’échec du traitement hormonal thyroïdien de substitution et en conséquence de l’échec du traitement de la fibromyalgie et du syndrome de la fatigue chronique.
Voilà pourquoi fibromyalgie et hypothyroïdie sont étroitement intriquées tant sur les plans diagnostiques que thérapeutiques.
Où réside le problème ? C’est la fourchette des valeurs de référence de la TSH qui pose problème. Selon l’AACE (Association Américaine des Cliniciens Endocrinologues) et des études plus récentes, la soi-disant “norme” a des limites trop larges, laissant, si leurs médecins ne s’y réfèrent pas, des dizaines de milliers de patients souffrir d’hypothyroïdie qui devraient bénéficier d’un traitement mais ne le reçoivent pas.
Il y a des relations étroites entre l’hypothyroïdie, la fibromyalgie et le syndrome de fatigue chronique, entre la thyroïde et la ménopause, entre la leptine, le surpoids et la thyroïde, entre la thyroïde et les glandes surrénales, entre la thyroïde, le gluten et l’intestin. L’hypothyroïdie est un état pathologique caractéristique d’un défaut de production des hormones thyroïdiennes. On peut considérer la thyroïde comme étant la boite de vitesse d’un véhicule sophistiqué. Si la boite de vitesse est endommagée, c’est le moteur dans son ensemble qui fait défaut. En d’autres termes, un déficit en hormones thyroïdiennes n’est pas compatible avec une santé normale. Bien que la thyroïde produise davantage de T4 (80%) que de T3 (20%), la T3 est 300% plus active que la T4.
La T3 est la véritable hormone active agissant sur le métabolisme. T4 est la forme de stockage de l’hormone thyroïdienne (décrite parfois comme une pro-hormone). L’hormone T4 est convertie par une enzyme, la 5′- déiodinase, en l’hormone active T3 dans le foie et à l’intérieur des cellules des organes concernés (T4 est convertie en T3 en perdant un atome d’iode) Une autre enzyme, la 5 – déiodinase, convertit en permanence de la T4 en reverse-T3 (rT3). La reverse-T3, qui est un stéréo-isomère de la T3, ne stimule pas le métabolisme, elle n’est pas biologiquement active. Sa production sert à éliminer la T4 de l’organisme. Mais la reverse-T3 peut se lier aux récepteurs intracellulaires de la T3 et les bloque.
Une privation alimentaire (telle que le jeûne ou la famine), une maladie quelle qu’elle soit, un stress physique ou émotionnel (qui accroissent le taux sanguin de cortisol, l’hormone du stress), le pourcentage de conversion change, moins de T4 est convertie en T3 et davantage en reverse-T3 La réduction du taux de T3, qui se produit sous de telles conditions, ralentit le métabolisme de nombre de tissus…d’ou les échecs systématiques a long terme des « régimes » : qu’ils soient hyper protéinés ou pas . Ainsi, la reverse-T3 agit à notre encontre, contribuant à engendrer tous les symptômes de l’hypothyroïdie.
Pour certains médecins, la T3 libre serait le test le plus utile. Une T3 libre basse dans les valeurs de référence, avec une soi-disant TSH “normale”, serait, à leurs yeux, un argument de poids pour statuer d’une hypothyroïdie. Je partage ce point de vue. Je reviendrai plus loin sur ce point essentiel de la valeur “normale” de la TSH.
Une T4 libre dans la norme n’indique pas si l’organisme la convertit en T3 libre comme il faudrait. De nombreux individus, en particulier les femmes, ne convertissent pas de façon adéquate la T4 en hormone T3 active, d’où une hypothyroïdie symptomatique avec une soi-disant TSH “normale”.
Malheureusement, de nombreux médecins de demandent pas de façon systématique un dosage de la T3 libre.
PRINCIPALES CAUSES DE L’HYPOTHYROIDIE
Il y a différentes causes possibles à l’insuffisance de production des hormones thyroïdiennes.
• La thyroïdite auto-immune d’Hashimoto est la plus fréquente d’hypothyroïdie • Un traitement antérieur pour hyperthyroïdie • Une déficience en iode • Certains médicaments • Une conversion insuffisante de T4 en T3 • Un dysfonctionnement pituitaire • Une résistance aux hormones thyroïdiennes • Une carence en vit D ( 100% de la population non complémentée ), en vit A, en Magnésium (90%), en FER, en sélénium (80%), en zinc (60-70%), B12 ( 80-90%), etc
HYPOTHYROIDIE : LES SYMPTOMES
L’hypothyroïdie ralentie le métabolisme de d’organisme de façon habituellement progressive. L’hypoactivité thyroïdienne peut entraîner une diversité étonnante de symptômes étant donné que chacune des fonctions de l’organisme peut être affectée. Les symptômes varient de modérés à sévères: • Faiblesse, fatigue, somnolence • Prise de poids, difficulté à perdre du poids • Dépression : 35% des dépressions auraient comme seule cause l’hypothyroïdie non diagnostiquée car « la TSH est normale » • Anxiété, crises de panique • Sommeil non récupérateur : fatigue surtout au réveil, état dépressif le matin. • Ronflements, apnée du sommeil : rétention d’eau au niveau du palais et de la langue. • Intolérance au froid (frilosité constante), moindres sueurs • Constipation, ralentissement vidange gastrique • Température matinale basse • Extrémités froides, voir syndrome de Raynaud : doigts bleus en hiver. • Douleurs / courbatures corporelles surtout le matin. • Rigidité articulaire surtout le matin, crampes aux mollets. • Gonflement du visage et/ou des extrémités : rétention d’eau (œdème) • Peau sèche, rugueuse, eczéma • Chute des cheveux, ou cheveux secs, ongles fragiles, cassants • Voix rauque, diminution de l’audition • Essoufflement • Palpitations (tout comme l’hyperthyroïdie ) • Trouble de la mémoire : ralentissement intellectuel. • Trouble de la concentration motivation réduite • Règles irrégulières ou abondantes, Syndrome prémenstruel • Chute de la libido • Infertilité, fausses couches à répétition : 1ere cause après anomalies génétiques • La glande thyroïde est typiquement élargie, ferme et rugueuse. Elle peut être de taille normale, voire impalpable • Visage bouffi et gonflement péri-orbital • Peau froide et sèche • Chute des cheveux et parfois du tiers externe des sourcils : signe de Hertoghe • Bradycardie (pouls lent) • Pression artérielle diastolique haute • Diminution des réflexes Achilléens • Macroglossie (langue élargie) avec empreinte des dents sur les côtés • Voix rauque • Allocution lente • Syndrome du canal carpien
J’estime que s’il y a 2-3 signes majeurs (frilosité, température à moins de 36° le matin, fatigue matinale, œdème péri orbitaire, constipation ), il est licite d’entamer un traitement efficace (mélanges T3-T4), surtout pas T4 (L-thyroxine®, Eutyrox®, Levothyrox®) : car celui-ci bien souvent n’est pas efficace, voir aggrave l’hypothyroïdie par : – Excès de transformation de la T4 en REVERSE T3 – ou non transformation de la T4 inactive en T3 active par carence en vit D, Mg, Fer, Se, Zinc etc
Maladies auto-immunes : la connexion gluten-thyroïde fait partie de ce contexte auto-immun.
Les maladies auto-immunes sont des affections causées par la production d’une réponse immunitaire inappropriée dirigée par l’organisme contre ses propres tissues. Il arrive que le système immunitaire cesse de reconnaître comme lui étant propre, un ou davantage des composants normaux de l’organisme, créant des auto- anticorps qui vont attaquer ses propres cellules, tissues et/ou organes. Cela induit une inflammation, provoque des dégâts et conduit à des affections auto-immunes.
La cause des maladies auto-immunes est inconnue, mais il semble exister fréquemment une prédisposition génétique à leur développement….et une dysbiose : mauvaise flore intestinale liée au gluten moderne, au lait de vache, aspartame, antiacides IPP, antibiotiques, excès d’alcool etc.
– Il y a celles dont le processus auto-immun n’attaque qu’un seul tissu ou organe, à savoir: thyroïdite d’Hashimoto (thyroïde), maladie cœliaque, maladie de Crohn et recto-colite hémorragique (tractus gastro-intestinal), maladie d’Addison (surrénale), diabète type 1 (îlots pancréatiques), cirrhose biliaire primitive, cholangite sclérosante primitive, hépatite auto-immune (foie), sclérose en plaques, syndrome de Guillan-Barré (système nerveux).
– Et celles qui endommagent de nombreux organes, les maladies auto-immunes systémiques (lupus érythémateux disséminé, syndrome de Sjögren, polyarthrite rhumatoïde, pseudo-polyarthrite rhizomélique, maladie de Horton, spondylarthrite ankylosante, maladie de Behçet, granulomatose de Wegener, syndrome de Goodpasture).
Des études montrent que 90% des personnes souffrant d’hypothyroïdie produisent des anticorps contre la glande thyroïde. La thyroïdite auto-immune de Hashimoto est caractérisée par la présence dans le sang d’un nombre accru d’anticorps antithyroïdiens: les anticorps anti-thyroïde peroxydase (anti-TPO, également appelés anticorps anti- microsomes) et les anticorps anti-thyroglobuline. Ces anticorps réagissent contre les protéines de la glande thyroïde et initient une réaction inflammatoire qui va provoquer une attaque et une destruction progressive des cellules thyroïdiennes, ce qui conduit à une défaillance de la glande thyroïde. La mise en évidence des anticorps anti-TPO et/ou anti-thyroglobuline au cours de dépistages peut conduire au diagnostic d’une pathologie thyroïdienne infra-clinique. Cependant, les anticorps pouvant se développer avec le temps, des dosages répétés doivent être effectués. Deux autres types d’anticorps peuvent être retrouvés dans les thyroïdites auto-immunes: les immunoglobulines qui stimulent le récepteur de la TSH dans les cellules de la thyroïde (anticorps TSI), qui sont la cause de l’hyperthyroïdie de la maladie de Basedow (maladie de Graves pour les Anglo-saxons) et les anticorps anti- récepteurs de la TSH • L’iode en faible teneur (ainsi qu’une faible teneur en certains minéraux tels que le sélénium, le zinc et le fer) peut entraîner une inflammation de la thyroïde • La perméabilité intestinale joue un rôle dans la maladie d’Hashimoto. 60 – 80% du système immunitaire est situé dans l’intestin, • La maladie d’Hashimoto peut être de cause génétique. Et la maladie d’Hashimoto est associée à d’autres maladies auto-immunes telles qu’au diabète de type 1 et à la maladie cœliaque. Cela signifie que les patients qui ont été diagnostiqués avec un trouble auto-immun ont également un plus grand risque d’en développer une autre, y compris la maladie d’Hashimoto. • Un changement conséquent dans les concentrations d’hormones sexuelles lors de la grossesse et de la ménopause peut également être un facteur prédisposant au développement d’une maladie d’Hashimoto, en raison de l’activité alors accrue du système immunitaire. La thyroïdite d’Hashimoto s’installe habituellement de façon insidieuse, avec des symptômes et des signes cliniques progressant sur des mois, voire des années, en raison d’une lente et constante destruction de la glande, qui finalement se solde par une incapacité de la thyroïde à produire suffisamment d’hormones thyroïdienne, réalisant une hypothyroïdie clinique patente.
Autres troubles biologiques : • Une anémie est rencontrée dans 30 à 40% des hypothyroïdies, habituellement due une diminution de l’érythropoïèse (processus de formation des globules rouges), parfois à un déficit en fer, vitamine B12 ou d’acide folique. • Augmentation du taux du cholestérol total, du LDL (le “mauvais” cholestérol), et des triglycérides. Selon mon expérience : 90-95% des hypercholestérolémies a « mauvais cholestérol LDL sont résolues en traitant l’hypothyroïdie sous-jacente sans nécessité de donner ces poisons légaux que sont les statines (Zocor®, Lipitor®, Crestor®,Vasten®,Tahor® etc.) • Un taux de prolactine parfois élevé pouvant décroître l’activité de la GnRH (gonadotropin-releasing hormone) et ainsi réduire la synthèse et la sécrétion des hormones gonadotropes (FSH et LH), résultant en des troubles menstruels, des cycles anovulatoires, une galactorrhée, et une infertilité chez certaines patientes.
THYROIDE et MALADIE COELIAQUE / SENSIBILITE AU GLUTEN : relations Hashimoto/Gluten
Les produits contenant du gluten fragilisent les parois de l’intestin et peuvent faciliter la perméabilité intestinale. Le gluten (blé moderne n’est plus un aliment, mais un corps étranger pourvoyeur de nouvelles maladies : syndrome de fatigue chronique, fibromyalgie, explosion de maladies auto-immunes. Comment s’explique la relation thyroïde-gluten ? Il s’agit d’une “usurpation” d’identité. La structure moléculaire de la gliadine ressemble étroitement à celle de la glande thyroïde. Lorsque la gliadine fait effraction à travers la barrière protectrice de l’intestin et pénètre dans la circulation sanguine, le système immunitaire intervient pour la détruire, exacerbant ainsi les réactions auto-immunes de l’organisme. Les anticorps anti-gliadine vont venir également attaquer directement les tissus de la thyroïde. Des études montrent que le gluten joue un rôle dans le développement de maladies auto-immunes comme la maladie d’Hashimoto, tout comme il est capable d’entretenir ou d’aggraver une maladie d’Hashimoto préexistante. Le retrait complet et définitif du gluten de l’alimentation fait partie intégrante et indispensable au style de vie à adopter pour une bonne gestion de la maladie d’Hashimoto et autres maladies auto-immunes.
Relations THYROIDE / MENOPAUSE •
De nombreuses femmes confondent les symptômes d’hypothyroïdie avec ceux de la ménopause. Insomnie, irritabilité, dépression, palpitations et troubles cognitifs sont des symptômes communs aux deux.
• Entre 35 et 50 ans, la production de progestérone est réduite de 75%, alors que pendant cette même période, les œstrogènes ne déclinent que de 35%. A la ménopause, la production de progestérone est extrêmement faible, alors que les œstrogènes sont encore présents environ de moitié de leurs niveaux de la pré-ménopause.
Cela signifie qu’à la ménopause les ovaires cesseront de fabriquer de la progestérone bien avant de cesser leur production d’œstrogènes. La dominance en œstrogènes est causée par un excès d’œstrogènes par rapport à la quantité de progestérone qui est disponible pour équilibrer ou inactiver les effets des œstrogènes. Elle se manifestera d’autant plus si un stress mal contrôlé empêchera les surrénales de prendre la relève pour produire de la progestérone.
• Signes et symptômes de la dominance en œstrogènes. Ils incluent: seins gonflés et sensibles, seins fibrokystiques, fibromes utérin, endométriose, menstruations irrégulières ou manquantes, augmentation de caillots menstruels, PMS (syndrome prémenstruel), baisse de la libido, rétention d’eau (pieds et doigts gonflés), ballonnements, gain en masse adipeuse (spécialement à l’abdomen, aux cuisses et aux hanches), crampes, fatigue constante, perte de mémoire, humeurs changeantes, irritabilité, dépression et anxiété, chute des cheveux, maux de tête, hypoglycémie, insomnie, yeux secs, peau sèche, ostéoporose, accélération du processus de vieillissement. On retrouve nombre de symptômes de l’hypothyroïdie.
La progestérone facilite l’action des hormones thyroïdiennes, tandis que les œstrogènes sont antagoniques à ces mêmes hormones. Ainsi, si une femme a une progestérone basse et/ou un taux élevé en œstrogènes, les hormones thyroïdiennes auront plus de difficultés à agir. Les symptômes d’hypothyroïdie peuvent survenir en raison d’une dominance en œstrogènes. La dominance en œstrogènes est à l’origine de nombreux cas d’hypothyroïdies vers la quarantaine. Lorsque les œstrogènes ne sont pas contrebalancés par la progestérone, ils rendent les récepteurs cellulaires à l’hormone thyroïdienne moins réceptifs à cette dernière, de sorte que même si la glande thyroïde produit une quantité normale d’hormones, celles-ci sont rendues inefficaces et les symptômes d’hypothyroïdie apparaissent. Dans ce cas, puisque le trouble ne vient pas de la glande thyroïde elle-même, les tests hormonaux peuvent être normaux. Prescrire de la progestérone aidera à améliorer la réponse cellulaire à ces hormones. La plupart des symptômes seront grandement atténués. Ainsi, beaucoup de femmes pré-ménopausées, ménopausées ou post-ménopausées, présentant des signes cliniques d’hypothyroïdie, comme une fatigue, un manque d’énergie ou une intolérance au froid, souffrent en réalité d’une dominance en œstrogènes méconnue et bénéficieraient d’une supplémentation en progestérone naturelle. Les œstrogènes en excès, non contrebalancées par un manque de progestérone, accroissent la synthèse de la thyroxin-bounding globulin (TBG), la protéine-transporteuse, produite dans le foie, à laquelle sont liées les hormones thyroïdiennes, rendant ainsi ces hormones partiellement inactives. Seules les hormones libres – non liées – sont actives. Un excès en TBG, agissant comme réservoir d’hormones, augmente donc la proportion inactive des hormones au détriment de la portion libre dès lors moins disponible pour les tissus.
Les œstrogènes sont connus également pour réduire la conversion de T4 en T3, conduisant ainsi à une conversion préférentielle en reverse-T3 (une T3 inactive).
L’excès de reverse-T3, en bloquant les récepteurs, comme une clé défectueuse dans une serrure, ralentit l’activité cellulaire. Sous l’influence des œstrogènes, les calories alimentaires sont emmagasinées dans le corps sous forme de graisses. Les hormones thyroïdiennes transforment les calories contenues dans les graisses en énergie utilisable. Ainsi, hormones thyroïdiennes et œstrogènes ont des actions opposées.
La dominance en œstrogènes en affectant les récepteurs thyroïdiens va être responsable d’une hypothyroïdie fonctionnelle, laquelle va occasionner une prise de poids par accumulation de graisses autour des hanches, des cuisses et à la partie basse l’abdomen.
Cette prise de poids se fera malgré toute tentative de diète ou d’exercices physiques.
L’hypothyroïdie fonctionnelle et la prise de poids ne seront en rien corrigées par la prescription d’un traitement hormonal thyroïdien substitutif, lequel ne prendra pas compte du problème sous-jacent, à savoir la dominance en œstrogènes.
Seul un traitement par la progestérone naturelle permettra de réduire cette surcharge pondérale en équilibrant la dominance en œstrogènes et en réactivant les récepteurs thyroïdiens. La dominance en œstrogènes va disparaître et les récepteurs thyroïdiens fonctionneront à nouveau pleinement, normalisant ainsi l’hypothyroïdie.
LEPTINE, OBESITE et HYPOTHYROIDIE
Bien que la cause de l’obésité soit multifactorielle, de nombreuses études ont démontré que presque toutes les personnes en surpoids et obèses ont des dysfonctionnements métaboliques et endocriniens qui sont à l’origine de leur l’incapacité à perdre du poids ou qui y contribuent.
L’hormone leptine s’est révélée jouer un rôle majeur dans la régulation du poids corporel et du métabolisme.
Nous allons voir par quels mécanismes une résistance à la leptine peut être responsable d’un surpoids, La leptine est une hormone produite par les cellules graisseuses. Elle a pour mission d’envoyer au cerveau des signaux pour accélérer le métabolisme des graisses et supprimer les fringales Chez les personnes chroniquement en surpoids, le problème vient du fait que cette signalisation hypothalamique par la leptine est inopérante et qu’elle n’agit pas pour réduire l’appétit et stimuler la dégradation des graisses (lipolyse). Les scientifiques appellent cet état “la résistance à la leptine”. Les études montrent que la majorité des individus en surpoids qui ont de la difficulté à perdre du poids ont des degrés divers de résistance à la leptine, où la leptine a une moindre capacité de produire ses effets normaux sur l’hypothalamus et pour réguler le métabolisme. Cette résistance à la leptine est ressentie comme la faim, alors de multiples mécanismes sont activés pour augmenter le stockage de la graisse, plutôt que de brûler des réserves de graisse, car le corps essaie de compenser la perception de faim.
La résistance à la leptine active donc fortement l’appétit (par le neuropeptide Y) et les solutions radicales employées par beaucoup, tels les régimes trop bas en calories, s’avèrent inefficaces à la longue; ce sont les régimes “yo-yo” où à une perte de quelques kilos, s’en suit un gain rapide, voire plus important. Les mécanismes qui sont activés pour augmenter le stockage de la graisse se font par le biais d’une diminution du métabolisme de base, et donc celui de la thyroïde.
Ces mécanismes comprennent une diminution de la sécrétion de TSH, une réduction de la conversion de T4 en T3, une augmentation de la reverse-T3, une augmentation de l’appétit, une augmentation de la résistance à l’insuline et une inhibition de la lipolyse (dégradation des graisses).
Ces mécanismes peuvent être en partie dus à une régulation négative des récepteurs de la leptine qui se produit lors d’une élévation prolongée des taux de leptine. Cela signifie qu’une fois en surpoids pendant une longue période de temps, il devient de plus en plus difficile de perdre du poids. Le fait que la résistance à la leptine stimule la formation de la reverse-T3 Ce mécanisme de renversement est activé en temps de famine et chez les animaux qui hibernent, afin de diminuer le métabolisme. Des études démontrent que les régimes (en particulier les régimes qui provoquent l’effet “yo-yo”) peuvent mettre cette hormone reverse-T3 en action. La production de la reverse-T3 est l’un des principaux moyens qu’utilise le corps pour “essayer” de regagner le poids perdu après un régime amaigrissant. Dès que le corps détecte une réduction de calories, la production de la reverse-T3 est enclenchée pour diminuer le métabolisme. Avec les régimes récurrents (régimes entrecoupés de périodes sans régime), le corps reste souvent dans ce “mode de famine”, avec des niveaux élevés d’hormone reverse-T3 et une baisse des niveaux de l’hormone T3; ceci est l’une des raisons principales de la récupération du poids perdu avec les régimes. Ainsi, chez les personnes en surpoids ou obèses, la fonction de la thyroïde est perturbée en raison d’une leptine élevée (résistance à la leptine) Cela prouve encore une fois combien les dosages de la TSH et de la T4 ne renseignent pas du bon fonctionnement cellulaire de la thyroïde. Les tests sur un ratio T3 libre/reverse-T3 seraient des plus utiles. En outre, presque tous les diabétiques ont une résistance à la leptine. Il a été démontré chez les diabétiques que la résistance à la leptine peut réduire jusqu’à 50% la conversion de T4 en T3, sans élévation de la TSH, rendant très difficile pour les diabétiques de type II à perdre du poids.
Le syndrome de fatigue chronique et la fibromyalgie sont également affectés par une conversion réduite de T4 en T3, expliquant qu’un nombre élevé de ces patients présentent des symptômes d’hypothyroïdie avec une TSH dans la norme. Cela n’est pas surprenant, puisque les chercheurs ont montré qu’une mauvaise signalisation de la leptine affecte le système immunitaire et peut être un élément déclencheur de maladies auto-immunes.
Quelles sont les autres raisons pour un patient souffrant d’hypothyroïdie de faire trop d’hormone reverse-T3 ?
En plus des stress chroniques, il y a des causes physiologiques, fréquemment rencontrées, liées aux glandes surrénales (cortisol bas, connu comme la fatigue surrénale), à de faibles niveaux de fer et de vitamine B12, => d’inflammation chronique.
📷
Relations THYROIDE / SURRENALE : la fatigue surrénale
La fatigue surrénale est définie par une insuffisance partielle en cortisol. La fatigue surrénale est un état dû à des problèmes liés au mode de vie, généralement un stress chronique physique ou émotionnel, pollution par métaux lourds.
Signes et symptômes de la fatigue surrénale :
La liste est longue, elle inclue: faiblesse, manque d’énergie le matin et dans l’après-midi entre 15 et 17 heures, besoin de café et de stimulants pour “fonctionner”, allergies, fréquence accrue aux infections grippales et respiratoires (qui tendent à se prolonger), douleurs musculaires et articulaires, malaises, pression artérielle basse, hypoglycémie, baisse de la température corporelle, fringale et attirance pour le sel et les aliments salés, mauvaise qualité du sommeil, cernes sous les yeux, chute des cheveux inexpliquée, peau fine et sèche, ongles barrés de stries pigmentées, efforts accrus pour les activités quotidiennes, difficultés à appréhender le stress, tendance à trembler sous pression, nervosité, anxiété, dépression, mauvaise mémoire, léthargie, augmentation des troubles prémenstruels, fibrose des seins, chute de la libido, vieillissement prématuré (manque de DHEA).
La fatigue surrénale est peut-être la cause la plus fréquente de l’insuffisance de la thyroïde, Pour assurer la survie, les glandes surrénales forcent le corps à réguler à la baisse la production d’énergie, mettant l’organisme dans un état de catabolisme La glande thyroïde, qui contrôle le métabolisme, va réguler son activité à la baisse en réduisant la production des hormones T4 et T3. Cela va aussi conduire à une augmentation de la thyroid-binding globulin (TBG), leur protéine-porteuse.
Comme dans le cas de la dominance en œstrogènes, l’accroissement du taux de TBG va se traduire par davantage d’hormones liées proportionnellement aux hormones libres actives disponibles pour les cellules. D’où une réduction des taux circulant sanguins de T4 et T3 libres. De plus, ce système bien orchestré de survie va diriger une plus grande conversion de T4 en reverse-T3, hormone inactive et antagoniste de T3 libre. La thérapie de substitution par l’hormone thyroïdienne sans d’abord considérer le traitement des surrénales est une erreur courante et conduit souvent à une aggravation de l’état de fatigue surrénale au cours du temps et a l’intolérance au traitement thyroïdien : effets secondaires : palpitations, tremblements, insomnies etc. 70% des personnes qui prennent un traitement hormonal thyroïdien de substitution continuent de se plaindre de symptômes d’hypothyroïdie. Il n’est pas rare de rencontrer simultanément les symptômes d’une hypoactivité surrénalienne et ceux d’une hypoactivité thyroïdienne.
La plupart des médecins passent à côté en raison de leur ignorance de la fatigue surrénale. En cas de fatigue surrénale, les hormones surrénales, le cortisol (urines de 24h ou cortisol libre 8h du matin ou salivaire ) et la DHEA sont basses, mais encore dans les valeurs de références normales (rien à voir avec les taux effondrés de la maladie d’Addison). En fait, ces hormones surrénales peuvent être de moitié de la valeur optimale et toujours s’afficher “normales”. Une telle “normalité” ne signifie pas que le patient est indemne de toute fatigue surrénale; en réalité ses glandes surrénales fonctionnent de manière sous-optimale, avec des signes et des symptômes évidents de détresse.
Donc d’abord monter le cortisol (méthylprednisolone, prednisolone, hydro-cortisone AVANT de monter les doses du traitement thyroïdien
COMPLICATIONS DE L’HYPOTHYROIDIE :
• Maladie du cœur et accident vasculaire cérébral. Il est primordial de traiter une thyroïde hypoactive pour réduire le taux de cholestérol, particulièrement le LDL, responsable de dépôts graisseux dans la paroi des artères, afin d’éviter les risques de maladies du cœur et d’accidents vasculaires cérébraux.
Tous les patients présentant une hypercholestérolémie (et/ou hypertriglycéridémie) devraient subir un dépistage d’une éventuelle hypothyroïdie (entre autres causes de dyslipidémie secondaire), avant l’instauration une thérapie hypolipidémiante spécifique.
• L’hypothyroïdie peut conduire à une résistance à l’insuline/diabète type 2
• Risques d’une hypothyroïdie non traitée :
Les individus avec une hypothyroïdie non traitée ont un risque accru de: Infections Infertilité Avortement Donner naissance à un bébé avec des anomalies congénitales Défaillance cardiaque: l’hypothyroïdie peut affecter la contraction du muscle cardiaque et accroître le risque de défaillance cardiaque chez un patient cardiaque. Anémie par déficit en fer Dépression (courante dans l’hypothyroïdie): elle peut être sévère. L’hypothyroïdie doit être considérée comme une cause possible de dépression chronique, particulièrement chez les femmes âgées. Avec le temps, une hypothyroïdie non traitée peut créer des troubles mentaux et du comportement, éventuellement une démence.
• Le coma myxœdémateux
NORMES
. De nombreux patients avec une TSH supérieure à 1.5 (et non pas 5.0) présentent des symptômes classiques et des signes d’hypothyroïdie.
L’attente des patients est de se voir débarrassés de leurs symptômes présents, aussi subtiles soient-ils, qui empoisonnent leur existence de tous les jours…quels que soient les valeurs sanguines de TSH ou autres dosages. La gestion des symptômes et le rétablissement du bien-être priment avant tout. Plus précisément, quels que soient les niveaux de la TSH, tous les patients présentant un quelconque degré d’hypothyroïdie (hypothyroïdie infra-clinique ou clinique patente) en raison d’une thyroïdite auto-immune d’Hashimoto (présence d’anticorps antithyroïdiens) doivent être traités avec l’hormone thyroïdienne de substitution.
Cela résume la majorité des cas. Le traitement doit être à vie, le patient restant hypothyroïdien quand il ou elle cesse l’utilisation de l’hormone thyroïdienne. Une fois que le patient a commencé à prendre le traitement, les taux d’anticorps devraient habituellement diminuer.
Mais dans la thyroïdite auto-immune d’Hashimoto prendre l’hormone de substitution ne suffit pas
Il y a un consensus sur la nécessité de traiter l’hypothyroïdie infra-clinique, quel que soit son degré, chez toutes femmes enceintes et celles qui envisagent une grossesse, pour diminuer le risque de complications de la grossesse et d’un développement défectueux in utero. Et les risques sont encore plus grands en présence d’anticorps antithyroïdiens élevés. Une femme présentant des symptômes évidents, aussi minimes soient-ils, de défaillance thyroïdienne aura du mal à obtenir et/ou maintenir une grossesse si son taux de TSH est supérieur à 2 mUI/l, de façon optimale entre 1 et 2.
Dr. Norbert Kurland, Résumé par le Dr Stéphane Résimont (https://www.docteur-resimont.com/accueil)
Neurotransmetteurs déséquilibrés dans la fibromyalgie
Dans la fibromyalgie, au moins six neurotransmetteurs peuvent être déséquilibrés. Les neurotransmetteurs sont les substances chimiques du cerveau qui transportent les signaux (y compris les signaux de douleur) d'une cellule nerveuse à la suivante. Les neurotransmetteurs contrôlent littéralement tous les systèmes du corps, directement ou indirectement.
Les principaux symptômes de la fibromyalgie, la perception accrue de la douleur, la fatigue, les troubles du sommeil, la dépression et l'anxiété sont liés à ces neurotransmetteurs.
Les neurotransmetteurs impliqués dans la fibromyalgie se présentent par paires. Elles sont:
Sérotonine et mélatonineDopamine et norépinéphrineGABA et glutamate
Leurs niveaux peuvent être trop élevés, trop bas ou inefficacement fabriqués et utilisés par le corps.
Sérotonine et mélatonine
La sérotonine est l'un des principaux neurotransmetteurs de l'organisme. Il est fabriqué dans le cerveau et le tractus gastro-intestinal. La sérotonine joue un rôle important dans de nombreuses fonctions, notamment le sommeil, l'appétit, l'apprentissage et la perception de la douleur. Il est étroitement impliqué dans la détermination de notre humeur. Les niveaux de sérotonine sont généralement très bas chez les personnes souffrant de dépression.
La mélatonine est fabriquée à partir de sérotonine. La nuit, quand il fait noir, une certaine quantité de sérotonine est convertie en mélatonine , ce qui nous aide à nous endormir. Le matin, la sérotonine est libérée, ce qui nous aide à nous réveiller avec une sensation de fraîcheur.
Les niveaux de sérotonine sont généralement bas chez les personnes atteintes de fibromyalgie, ce qui rend également nos niveaux de mélatonine bas. C'est la principale raison des troubles du sommeil si caractéristiques de la fibromyalgie.
Le stress abaisse nos niveaux de sérotonine. Lorsqu'une personne est soumise à un stress émotionnel, son taux de sérotonine baisse automatiquement. La fibromyalgie est stressante car nous souffrons, nous nous sentons mal et la vie est devenue limitée. Le stress réduit les niveaux de sérotonine, ce qui crée un stress supplémentaire.
Dopamine et norépinéphrine
La dopamine et la norépinéphrine sont deux neurotransmetteurs essentiels qui régulent votre humeur et votre comportement. La norépinéphrine (également appelée noradrénaline) est produite à partir de dopamine.
La norépinéphrine joue un rôle central dans le contrôle de la vigilance, des cycles de repos, de l'attention et de la mémoire. Il joue également un rôle clé dans la réponse «combat ou fuite» .
La dopamine est un neurotransmetteur qui vous aide à concentrer votre attention. La dopamine joue également un rôle dans la modulation de la perception de la douleur et aide à réguler les mouvements.
Les personnes atteintes de fibromyalgie sont susceptibles d'avoir de faibles niveaux de dopamine. On pense que c'est la principale raison des problèmes cognitifs tels qu'une mauvaise mémoire, des difficultés de concentration et des confusions de mots. Une faible dopamine pourrait même être la cause de nos problèmes de coordination et d'équilibre.
GABA et glutamate
Le GABA et le glutamate sont deux neurotransmetteurs censés fonctionner en équilibre. L'un calme le cerveau tandis que l'autre stimule le cerveau. Votre cerveau utilise du glutamate pour produire du GABA, qui représente l'acide gamma-aminobutyrique. Ce sont les neurotransmetteurs les plus abondants du cerveau.
Le GABA calme le cerveau et participe au sommeil, à la relaxation, à la régulation de l'anxiété et à la fonction musculaire. Le glutamate stimule le cerveau pour que vous appreniez de nouvelles choses et que vous formiez des souvenirs.
La recherche suggère que les personnes atteintes de fibromyalgie ont des niveaux anormalement élevés de glutamate. On pense que le glutamate excessif provoque l'anxiété, l'agitation, l'incapacité de se concentrer et l'amplification de la douleur. Des niveaux élevés de glutamate sont liés à la dépression et à une faible fonction cognitive.
En raison de la relation étroite entre le GABA et le glutamate, les symptômes d'une carence en GABA se chevauchent avec ceux d'un excès de glutamate cérébral.
Stress psychologique et traumatisme.
Le stress semble augmenter le risque de développer une fibromyalgie ( Geenen et al., 2002 ). Il a été démontré que des facteurs psychologiques influencent la gravité de la douleur dans le syndrome de la fibromyalgie et peuvent moduler la gravité de la détresse perçue ( Bote et al., 2012 , 2013 ). Le rythme circadien normal pour le taux de cortisol plasmatique est perturbé chez les patients atteints de fibromyalgie , comme en témoignent les concentrations plasmatiques élevées le soir ( Crofford et al., 2004 ). L'hormone libérant de la corticotropine (CRH), le principal médiateur du système nerveux central de la réponse au stress, était élevée dans le liquide céphalorachidien (LCR) des patients atteints de fibromyalgie et était associée à des symptômes de douleur mais pas de fatigue ( McLean et al., 2006 ).
Le FMS est assez fréquent chez les patients atteints de mastocytose systémique ( Theoharides et al., 2015b ), un trouble caractérisé par un nombre plus élevé et une réactivité des mastocytes (MC) ( Theoharides et al., 2015c ). Le stress émotionnel est le déclencheur le plus courant des symptômes chez les patients atteints de mastocytose et est corrélé à des taux sériques élevés de CRH, dont un récepteur a été exprimé sur les MC de la moelle osseuse ( Theoharides et al., 2014 ). En fait, la CRH peut déclencher la libération sélective du facteur de croissance endothélial vasculaire (VEGF) à partir de MC humaines ( Cao et al., 2005 ) et agit également en synergie avec le neuropeptide neurotensine pour augmenter la libération de VEGF, augmentant la perméabilité vasculaire ( Donelan et al., 2006). La CRH entraîne également une perturbation de la barrière hémato-encéphalique ( Theoharides et Konstantinidou, 2007 ) par l'activation du MC cérébral ( Esposito et al., 2002 ).
Des études récentes ont rapporté que l'estradiol augmente les réactions immunitaires ( Kovats, 2015 ) et allergiques ( Hox et al., 2015 ). Nous avons montré que les MC expriment des récepteurs aux œstrogènes ( Pang et al., 1995 ) et que l' activation de MC induite par 17 β -estradiol augmentée par la substance P (SP) ( Theoharides et al., 1993 ). Ces résultats peuvent expliquer la prévalence plus élevée de FMS chez les femmes. Les niveaux de SP sont augmentés dans le LCR des patients atteints de FMS ( Russell, 1998 ), et la SP peut stimuler les MC ( Theoharides et al., 2010 , 2012a ). En fait, les MC induits par le SP expriment le récepteur 1 de la CRH ( Scholzen et al., 2001), et le récepteur SP de la neurokinine-1 a été impliqué dans la physiopathologie de la douleur ( Greenwood-Van Meerveld et al., 2014 ).
Le facteur de croissance nerveuse est élevé dans le LCR des patients atteints de FMS ( Giovengo et al., 1999 ) et a été considéré comme une cible pour le traitement analgésique ( Lewin et al., 2014 ). Les taux sériques, plasmatiques et LCR de facteur neurotrophique dérivé du cerveau sont élevés dans le FMS ( Nugraha et al., 2012 ), mais il n'est pas clair si cela est secondaire à un dysfonctionnement de son récepteur.
Carence nutritionnelles et fibromyalgie :
La fibromyalgie est associé à de multiples carence comme le manque de magnésium - fer - Vit D - B9 - B12 - sélénium - coenzyme Q10, carnitine, zinc etc…) et optimalisation des taux hormonaux : thyroïde (100% d’hypothyroïdie), cortisol (quasi 100% de déficience) DHEA - oestrogènes - testostérone - hormone de croissance - oxytocine, etc...
Traiter ces carences apporte un grand soutient.
L’apport de la naturopathie :
La fibromyalgie est lié au stress psychologique, au stress oxydatif globalement, un dérèglement mitochondriale et endocrinien, à l’épuisement, à des carences, un problème d’assimilation, une dysbiose intestinale, une hyper sensibilité nerveuse, à l’inflammation global de l’organisme. Pour améliorer cela la stratégie va être de régler la dysbiose, régénérer le système digestif, traiter les carences, régénérer le système nerveux et endocrinien (hormonal) en bref améliorer la vitalité de l’organisme.
Si vous souhaitez que je vous accompagne avec la naturopathie pour la fibromyalgie prenez rendez vous pour une consultation. Je me ferais un plaisir de vous suivre.









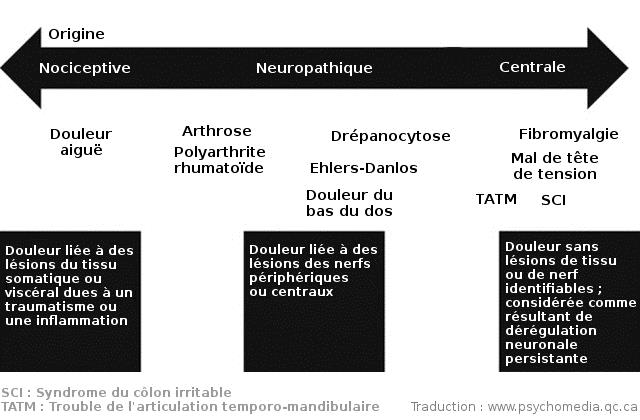

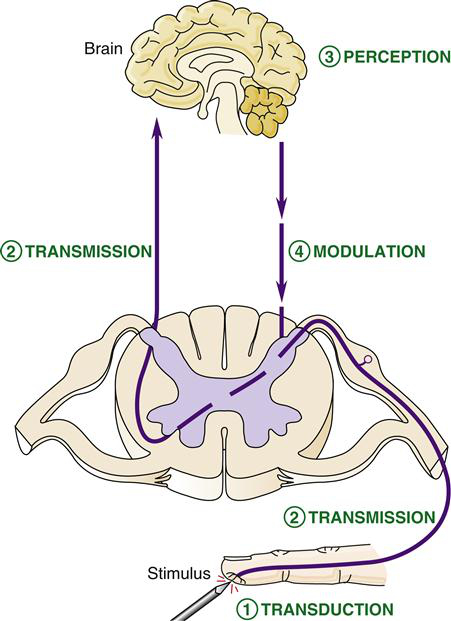

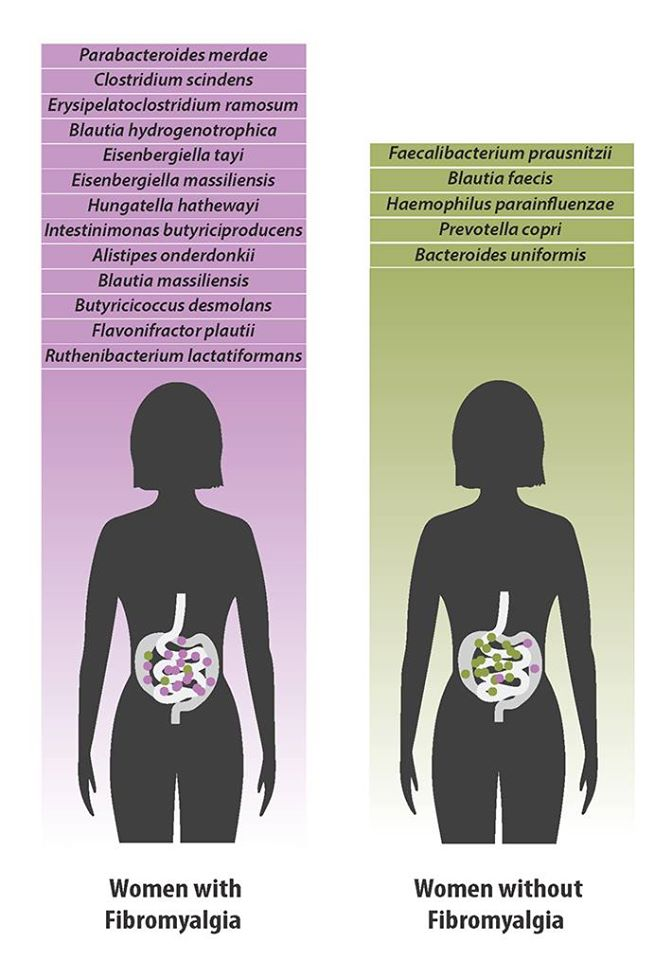

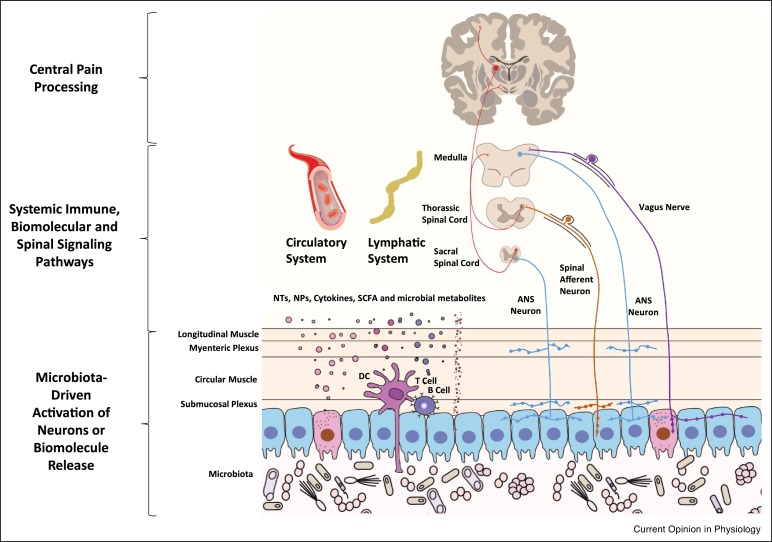

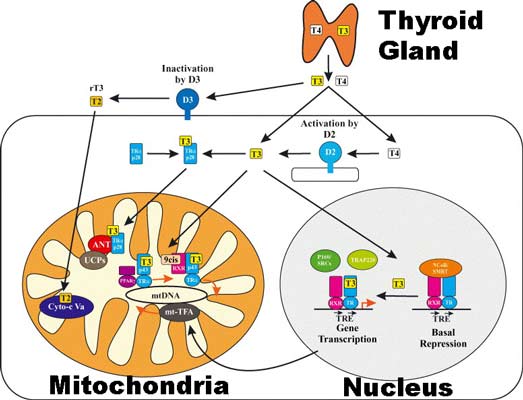


Commentaires